中国科学院院士、浙江大学医学院院长黄荷凤教授团队
构建风险评估综合模型,遗传性肿瘤源头防控实现新突破
超声检查显示莺歌已成功怀孕
莺歌的肿瘤基因家系图
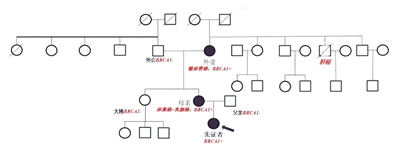
外婆、妈妈、女儿,祖孙三代被癌症基因困扰。正打算怀孕生子的女儿不想将这癌症基因再遗传给下一代,如何才能打破这一“魔咒”?
祖孙三代先后患病 源头竟指向同一致癌基因
2021年,当时23岁的莺歌婚后打算备孕,可是过了一年多,肚子一直没动静。去年6月,她和丈夫一起到浙大妇院检查,发现有子宫腺肌症、子宫内膜异位症,卵巢内还有囊肿,被诊断为原发性不孕症。同时,检查还发现丈夫的精子质量也不好。这意味着,夫妻俩如果要想生宝宝,很可能要借助辅助生殖技术(试管婴儿)。
很快,莺歌就接受了腹腔镜手术,剔除了右侧卵巢囊肿,还接受了腹腔镜下盆腔内异病灶电凝术和腹腔镜下盆腔粘连松解术等治疗。
一个月后,莺歌回到浙大妇院做助孕前的检查。可乳腺B超检查结果出来,又成了她备孕路上的“拦路虎”。检查发现她的双侧乳房有多个乳腺结节,尤其右侧乳头还有少量清水样溢液。随后又在浙大妇院做了右乳溢液导管剥离手术,术后病理显示为“导管内乳头状瘤”。
尽管不是恶性肿瘤,但莺歌的内心还是非常不安,因为她的母亲就患有卵巢癌和乳腺癌。
2018年,莺歌妈妈不幸确诊卵巢癌,她在浙大妇院先后做了4次手术,还经历了12次化疗和2年的免疫治疗,这些年来一直在与卵巢癌进行着苦苦的抗争。
2022年3月,莺歌妈妈在体检时又发现单侧乳腺结节,虽然只是1级的乳腺结节,常规来说定期随访就可以。但有了之前卵巢癌的经历,她还是毫不犹豫地决定做手术,把隐患彻底排除。没想到,病理结果出来还真是恶性肿瘤!
在莺歌的家族里,厄运不仅只降临在她妈妈的身上。20年前,莺歌外婆查出输卵管癌,当时也是在浙大妇院做了手术。
祖孙三代先后患病,会不会有遗传?带着这个疑问,莺歌和妈妈进行了基因检测,结果提示:母女两人均有BRCA1基因突变。
不想把致癌基因遗传给下一代
如何打破“魔咒”?
大家知道,BRCA1基因突变和乳腺癌、卵巢癌均密切相关。20世纪90年代,国外研究者发现了这种直接与遗传性乳腺癌有关的基因,有BRCA1和BRCA2基因突变者,罹患乳腺癌和卵巢癌的几率都会较普通人提高。
著名影星安吉丽娜·朱莉就因为携带BRCA1突变基因,致使她一生中患乳腺癌的概率高达87%,于是她先后进行了乳腺切除和卵巢切除手术,来预防乳腺癌和卵巢癌的发生。
当莺歌和妈妈拿到基因检测结果后,她们都不希望将这个致癌基因再遗传给下一代。能不能通过生殖辅助技术,将胚胎的BRCA1基因剔除,降低宝宝未来的患癌风险?为此,莺歌在妈妈的陪同下,找到了中国科学院院士、浙江大学医学院院长黄荷凤教授团队。
黄荷凤院士介绍,通过第三代试管婴儿技术,可以阻断明确的致病基因,像杜氏肌营养不良(DMD)、血友病、多囊肾等单基因遗传疾病,浙大妇院从上世纪90年代初就已经常规开展。
“但是肿瘤比较特殊,它属于多基因遗传病。”黄荷凤院士说,肿瘤的发生具有家族聚集性和遗传易感性,某些基因突变会增加患癌症的风险。比如携带BRCA1和BRCA2基因突变,会使女性70岁以前患乳腺癌的风险分别达到44%-78%和31%-56%。
但这些变异只占家族性聚集性乳腺癌病例的一小部分,因为除了BRCA1、BRCA2基因突变会增加患癌风险外,还有许多与乳腺癌易感性相关的遗传变异位点。此外,还叠加了环境因素等其他综合因素。
也就是说,虽然通过第三代试管婴儿技术可以剔除BRCA1基因,但仍不能排除多基因遗传导致的癌症风险。
构建风险评估综合模型
遗传性肿瘤源头防控实现新突破
有没有办法从单基因到多基因,进一步降低癌症风险呢?
黄荷凤院士提出了一个新思路——在辅助生殖过程中,对复杂疾病通过多基因遗传风险评分方法,对胚胎进行多基因疾病遗传风险评估,筛选疾病风险最低的胚胎移植,从而实现多基因遗传病的一级防控。
2022年,黄荷凤院士团队已经成功运用这项技术,为糖尿病的源头防控提供了可行的创新举措。这一次,在家系验证和生殖伦理均获通过后,团队将从莺歌的案例入手,向遗传性肿瘤的源头防控更进一步。
然而,如何构建能够准确预测疾病发生的多基因风险评分(PRS)模型,成为一大难题。
黄荷凤教授团队通过英国生物标本库(UK Biobank)中18483例女性乳腺癌患者样本和246222个对照样本的遗传信息和样本信息,建立了乳腺癌风险评估模型,用于胚胎的乳腺癌风险评估。
“考虑到亚洲人群乳腺癌的特点,我们在乳腺癌综合风险预测模型基础上,增加了313例亚洲人群乳腺癌数据信息,对该模型进行校正,结合乳腺癌易感基因变异风险和乳腺癌家族史,构建了更适合亚洲人群的乳腺癌风险评估综合模型,将更适用于中国人群。”黄荷凤院士说。
大数据筛选出肿瘤低风险胚胎
目前已成功受孕
经过长达数个月的攻关,乳腺癌终生患病风险评估综合模型终于构建完成。基于该模型,可同时评估胚胎乳腺癌的单基因及多基因致病风险。
今年3月,通过乳腺癌综合风险预测模型风险评估,黄荷凤院士团队从莺歌的三个胚胎中,筛选出了一枚综合评估低风险胚胎。
但是要成功进行胚胎移植,宫腔环境也至关重要。此时莺歌的子宫内膜生长过厚且不均,宫腔内还有息肉,暂时还不适合胚胎着床。于是再次进行宫腔镜治疗,摘除息肉。后来在浙大妇院生殖内分泌科朱依敏主任医师的精心治疗下,将子宫环境调整到最佳状态,终于在11月6日成功移植胚胎。
11月26日,好消息传来,莺歌已成功怀孕。得知这一好消息,莺歌和妈妈感慨不已。对她来说,这一路走来实属不易,现在她最期待的就是宝宝能顺利、健康地出生。
据了解,这是我国在遗传性肿瘤源头防控方面取得的创新性突破,也是黄荷凤院士团队在“从生命源头降低慢病、癌症风险,阻断遗传性出生缺陷”之路上又迈出了一大步。
如果家庭中多人患癌
建议做个多基因病风险评估
在11月30日召开的浙江省出生缺陷防治临床医学研究中心学术交流论坛上,莺歌的案例成为与会专家们探讨的焦点。这也是我国首例乳腺癌综合模型风险评估的PGT试管婴儿成功妊娠。
黄荷凤院士介绍,通过运用综合模型风险评估,可以预测子代患有多基因遗传病的风险,这项技术的广泛应用,将大大提升出生人口质量。对于有家族遗传病(如家族中有多人罹患恶性肿瘤),又有生育计划的适龄人群来说,用多基因风险评分来评估胚胎的遗传性肿瘤风险,具有非常重要的现实意义。
“某些癌症具有家族聚集性倾向。如果一个家系中较多成员,在相同或不同器官发生恶性肿瘤,就更推荐其在生育前进行风险评估。通过更精准地评估个体的患病风险,将有助于作出正确的风险管理决策。一级预防肿瘤易感子代的出生,可以有效降低家族性肿瘤代代传递的风险,从源头防控出生缺陷。”
2024年6月,浙江大学成立了医学遗传与发育研究院,设在浙江大学医学院附属妇产科医院钱江院区,占地5000平米。黄荷凤院士团队将重点聚焦生殖遗传、发育源性疾病、出生缺陷防控三大研究方向,针对目前存在的发育源性疾病机制不清、无临床预警,以及大多出生缺陷分子病理机制不明、鲜有治愈方法的挑战,就医源性生殖干预的生殖遗传效应、遗传病的早期预警与优生干预、发育源性疾病发生机制及防控、出生缺陷防控等开展研究,继续对其他多基因病开展综合模型风险评估的PGT技术,实现遗传性疾病、发育源性疾病的机制突破和出生缺陷的源头防控,提高出生人口质量,助力“健康中国”建设。
(为保护隐私,文内患者为化名)
版权和免责申明
凡注有"浙江在线"或电头为"浙江在线"的稿件,均为浙江在线独家版权所有,未经许可不得转载或镜像;授权转载必须注明来源为"浙江在线",并保留"浙江在线"的电头。








